Electrostatic:
Atomic Model Concept
Quantization of Charge
Conservation of Charge
Static electricity.
বিস্তারিত আলোচনা:
তাহলে দুই প্রকার মৌলিক আধানযুক্ত কণা পদার্থের পরমাণুর অভ্যন্তরে কিভাবে বিন্যস্ত থাকে এবং তাদের আচরন কিরূপ এই উত্তর খুঁজতে বিভিন্ন “পরমাণু প্রতিরূপ” (Atomic Model) প্রস্তাব করেছেন বিজ্ঞানীরা।

1. পরমাণুর টমসন মডেল (Thomson’s Model)
টমসন কল্পনা করেন যে পরমাণু যেন ধনাত্মক আধান এর নিরেট গোলক (শট পাট বল দেখেছ) যার ব্যাসার্ধ পরমাণুর ব্যাসার্ধের সমান। ইলেকট্রনগুলি এত বেশি সংখ্যায় গোলকের উপর (মধ্যে) গাঁথা আছে (কেকের মধ্যে চেরি যেমন গাঁথা থাকে) যাতে করে সমগ্র পরমাণু নিস্তড়িত হয়।
ত্রুটি : পরমাণুর ধনাত্মক আধানবাহী অংশের ব্যাসার্ধ সমগ্র পরমাণুর ব্যাসার্ধের তুলনায় অনেক কম (10 টু দি পাওয়ার -12 cm বা 10 টু দি পাওয়ার -9 m)। পরমাণু নিরেট গোলক নয়, বেশিরভাগ স্থান ফাঁকা।
সমাধান : টমসন এ প্রশ্নের সমাধান করেননি। সমাধান করতে এগিয়ে এলেন লেনার্ড।
লেনার্ড মডেল: (Lenard’s Model)
লেনার্ড দেখেন পাতলা বেধ এর পদার্থের মধ্য দিয়ে ক্যাথোড রশ্মি অবিচ্যূতভাবে অতিক্রম করতে পারে। পরমাণু নিরেট গোলক হলে এটা সম্ভব হতো না। 1930 খ্রিস্টাব্দে লেনার্ড প্রস্তাব দেন পরমাণুর বেশিরভাগ স্থান ফাঁকা এবং পরমাণুর ইলেকট্রন ও অনুরূপ ধনাত্মক কিছু ক্ষুদ্র ক্ষুদ্র মৌলিক কণা দ্বারা গঠিত।
ত্রুটি : পরমাণুর মধ্যে তাহলে ঐ কণাগুলি এখানে ওখানে ছড়িয়ে ছিটিয়ে থাকলে ধাতুকে উত্তপ্ত করলে কেন শুধুমাত্র ইলেকট্রন নির্গত হয়? (School বা College এ Common Room এ sir গেলে।)
সমাধান : এই সমস্যার সমাধানের জন্য রাদারফোর্ড নিজস্ব পরীক্ষালব্ধ মতামত দেন।
3. রাদারফোর্ড মডেল (Rutherford’s Model)
রাদারফোর্ড তার বিখ্যাত আলফা-কণা বিক্ষেপণ পরীক্ষার ফলাফলের উপর ভিত্তি করে পরমাণু গঠনের প্রতিরূপ প্রস্তাব করেন। সহজভাবে বলা যায় রাদারফোর্ডের মত অনুসারে প্রত্যেক পরমাণুর কেন্দ্রে ক্ষুদ্র পরিসরে ধনাত্মক আধানযুক্ত অঞ্চল হল নিউক্লিয়াস। ইলেকট্রনগুলি বিভিন্ন বৃত্তাকার কক্ষপথে নিউক্লিয়াসের চারদিকে ধনাত্মক আধান এর টানে ঘোরে । (আমাদের সবার বাড়িতে বৃদ্ধ-বৃদ্ধা দাদু -ঠাকুমার চারিদিকে আমরা)
ত্রুটি: (Text Book) ম্যাক্সওয়েলের তত্ত্ব অনুসারে আহিত (বোঝার সুবিধার্থে একটি ঘটনার উল্লেখ করছি। কাকেও সকালে বেশ পেট ভর্তি করে খাইয়ে একটি দন্ডে বা খুঁটিতে লম্বা দড়ি দিয়ে বেঁধে ঘুরতে বলা হলো! কি ঘটবে? –
শক্তি ক্রমশ কমবে এবং দড়ি দন্ডে পাক খাওয়ার দরুন ক্রমশঃ দড়ির (বৃত্তপথের) ব্যাসার্ধ কমবে, একসময় সমস্ত দড়ি পাক খেয়ে গিয়ে তুমি দেখবে দণ্ডের কাছে এসে দন্ডটির উপর আপতিত হবে এবং আর পাক খাওয়ার কোন উপায় থাকবেনা।
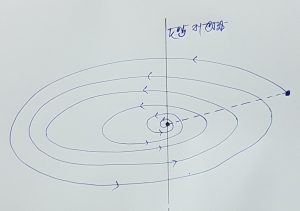
কণার ত্বরণ থাকলে কোনাটির ক্রমশ (শক্তি) (বিকিরণ নির্গত) শক্তি হ্রাস পায়, ফলে নিউক্লিয়াসের চারিদিকে বৃত্তপথে গতিশীল ইলেকট্রন ক্রমশ শক্তি হারালে বৃত্তপথের ব্যাসার্ধ ক্রমশ কমে এবং একসময় নিউক্লিয়াস এর উপর আপতিত হয়, পরস্পরকে প্রশমিত করে এবং নিউক্লিয়াস তথা পরমাণুর অস্তিত্ব থাকার কথা নয়। অর্থাৎ কোন পদার্থের অস্তিত্ব থাকার কথা নয়। কিন্তু বাস্তবে পদার্থের অস্তিত্ব আছে।
এছাড়াও ইলেকট্রন যদি ঘুর্ণনের সময় ক্রমশ শক্তি হারায় তাহলে পরমাণু থেকে নিরবচ্ছিন্নভাবে বর্ণালি পাওয়ার কথা। কিন্তু হাইড্রোজেন, হিলিয়াম ইত্যাদি মৌলের পারমাণবিক বর্ণালি হল রেখা বর্ণালি, নিরবচ্ছিন্ন নয়।
সমাধান : নীলস বোর এই ত্রুটির সংশোধন করেন।
4. বোরের পরমাণু মডেল (Bohr’s Model)
(Text Book)
বোরের পরমাণু প্রস্তাব সহজে বোধগম্য করে তোলার জন্য আমরা আমাদের প্রত্যেকে বাড়ির কথা যদি চিন্তা করি তাহলে বলতে পারি আমরা বাড়িতে যেখানে স্থায়ীভাবে বসবাস করি সেখানে থাকার জন্য কোন খরচ হয় না। পরমাণুর ইলেকট্রনগুলির থাকার জায়গাকে আমাদের বাড়ির মত নিজস্ব স্থায়ী (বাড়ি) কক্ষপথ বলে।
আবার আমরা যখন এক স্থায়ী বাড়ি থেকে অন্য কোনো স্থায়ী বাড়ি (আত্মীয় বাড়ি) বেড়াতে বা ঘুরতে বা কাজের জন্য যাই (সেখানে সারাজীবন থেকে যাই না কিন্তু; দু চারদিন থেকে ফিরে আসি যা সারা জীবন সময় সাপেক্ষে অত্যন্ত কম), তখন যাতায়াতের জন্য শক্তি (টাকা/পয়সা) খরচ করি অথবা বাচ্চা ছেলে আত্মীয় বাড়ি গেলে শক্তি (টাকা/পয়সা) পায়। ( ইলেকট্রনের ক্ষেত্রে ফিরে আসার সময় 10 টু দি পাওয়ার -8 s)
পরমাণুর গঠন সম্পর্কে আমরা এই স্থির তড়িৎ অংশে বোর তত্ত্ব পর্যন্ত জানবো। তবে বোর তত্ত্বের কিছু অসম্পূর্ণতা/ সীমাবদ্ধতা আছে। পরবর্তী ক্ষেত্রে আমরা সেসব নিয়ে আলোচনা করবো। এবং পরমাণু প্রতিরূপ তত্ত্বের আরো কিছু মতবাদ পড়ব। যেমন – সমারফেল্ড তত্ত্ব ও যান্ত্রিক তরঙ্গ প্রতিরূপ।
রাদারফোর্ড – বোরের মডেল অনুযায়ী একটি কেন্দ্রীয় মজ্জা কল্পনা করা হয় যাকে ঘিরে ইলেকট্রনগুলি নির্দিষ্ট শক্তি নিয়ে কক্ষপথে ঘুরতে থাকে। এই কেন্দ্রীয় মজ্জায় পরমাণুর প্রায় সমস্ত ভর জমা বা পুঞ্জিভূত থাকে এবং ইহা ধনাত্মক (+ve) তড়িৎগ্রস্ত। এই কেন্দ্রীয় মজ্জাকেই নিউক্লিয়াস বলে। [পরমাণুর ভর > ( ইলেকট্রন + প্রোটন) এর ভর; নিস্তড়িত নিউট্রন আবিষ্কার] নিউক্লিয়াস সাধারণত প্রোটন ও নিউট্রন নামে দুই ধরনের কণা দ্বারা গঠিত। প্রোটন ও নিউট্রনের ভর প্রায় সমান।

ইলেকট্রনের ভর প্রোটন ও নিউট্রনের তুলনায় কম। প্রতিটি ইলেকট্রনের ভর ও আধানের পরিমাণ সমান। ধনাত্মক নিউক্লিয়াস ও ঋণাত্মক (-ve) ইলেকট্রনের মধ্যে ক্রিয়ারত আকর্ষণ বলই ইলেকট্রনের ঘোরার জন্য প্রয়োজনীয় অভিকেন্দ্র বল যোগান দেয়।
সাধারণভাবে নিউক্লিয়াসের নিকটবর্তী কক্ষপথ অপেক্ষা দূরবর্তী কক্ষপথে পরিভ্রমণরত ইলেকট্রনগুলির বন্ধন বল (টান) কম হয়। [ যেমন – তোমার ক্ষেত্রে মামাবাড়ি, মামাবাড়ির মামাবাড়ি, তার মামাবাড়ি……] তাই দূরবর্তী কক্ষের ইলেকট্রনকে পরমাণু থেকে বিচ্ছিন্ন করা অপেক্ষাকৃত সহজ হয় (তবে সর্বনিম্ন শক্তির লাগেই।)
বিভিন্ন পদার্থের পরমাণু ওদের দুরতম কক্ষের ইলেকট্রনগুলিকে ভিন্ন ভিন্ন মানের আকর্ষণ বল দিয়ে আবদ্ধ রাখে। কাজেই দুটি বস্তুকে পরস্পরের ঘনিষ্ঠ সংস্পর্শে এনে ঘর্ষণ করলে উৎপন্ন শক্তির প্রভাবে যে পদার্থের বাইরের ইলেকট্রনের বন্ধন শক্তি কম তার থেকে অপর পদার্থে স্থানান্তরিত হয়। [ এক্ষেত্রে মনে রাখতে হবে ইলেকট্রন ভেঙে-ভেঙে স্থানান্তরিত হতে পারে না]। যে বস্তুটি ইলেকট্রন লাভ করে সেটি (-ve) ঋণাত্মক ভাবে তড়িৎ গ্রস্ত হয় যে পদার্থ ইলেকট্রন হারায় তা (+ve) ধনাত্মক তড়িৎ গ্রস্ত হয়। তড়িৎ- এর পরিমাণ (আধান) স্থানান্তরিত ইলেকট্রন সংখ্যার উপর নির্ভর করে। এবং এই ইলেকট্রন গ্রহণ বর্জন একইসঙ্গে ঘটে মনে রাখতে হবে।
তাই উপরোক্ত আলোচনা থেকে আমরা নিম্নলিখিত বিষয়গুলি পাই –
ঘর্ষণ থেকে প্রাপ্ত তড়িৎ কে ঘর্ষণজাত তড়িৎ বলে।
কোন বস্তুর আধান Q = +ne বা -ne হয়।
যেখানে n অবশ্যই (স্থানান্তরিত ইলেকট্রন সংখ্যা) পূর্ণ সংখ্যা হবে। একে আধানের খন্ডীভবন (Quantisation) বলে। কোন বস্তুর আধান ক্ষুদ্রতম আধানের (e) মানের সরল গুণিতক।
ঘর্ষণ থেকে একই সঙ্গে দুই প্রকার তড়িৎ (+ve ও -ve) পাওয়া যায়।
Visit our website http://onlineexamgroup.com regularly and get more updates. Prepare yourself for your final exam. Get all updates about Madhyamik and HS Exam, West Bengal.